THU HỒI THUỐC CHỨA RANITIDIN TRÊN TOÀN CẦU VÌ NHIỄM TẠP CHẤT GÂY UNG THƯ
Ranitidin thuộc nhóm thuốc : Đối kháng thụ thể H2 histamin.
Dạng thuốc và hàm lượng
Dạng Ranitidin hydroclorid.
Viên nang: 150 mg, 300 mg.
Dung dịch uống 75 mg/5 ml; gói bột 150 mg.
Viên nén: 25 mg, 75 mg, 150 mg, 300 mg.
Viên sủi bọt: 150 mg, 300 mg.
Thuốc tiêm 25 mg/ml (2 ml, 6 ml, 40 ml).
Dược lý và cơ chế tác dụng
Ranitidin là một thuốc đối kháng thụ thể H2 histamin có cơ chế tác dụng ức chế cạnh tranh với histamin ở các thụ thể H2 của tế bào thành dạ dày, làm giảm lượng acid dạ dày tiết ra cả ngày và đêm trong điều kiện cơ bản và cả trong tình trạng bị kích thích bởi thức ăn, insulin, acid amin, histamin hoặc pentagastrin. Ranitidin có tác dụng ức chế tiết acid dạ dày mạnh hơn cimetidin gấp 3 – 13 lần. Ranitidin có thể bảo vệ niêm mạc dạ dày chống chảy máu và tác dụng kích thích của một số thuốc (thí dụ aspirin, thuốc chống viêm không steroid).
Chỉ định
Điều trị loét dạ dày – tá tràng.
Trào ngược dạ dày – thực quản.
Hội chứng Zollinger – Ellison.
Loét do stress ở đường tiêu hóa trên.
Đề phòng nguy cơ sặc acid trong quá trình gây mê.
Chứng khó tiêu.
Chống chỉ định
Quá mẫn với ranitidin hoặc bất kỳ thành phần nào của chế phẩm
Ngày 02/10/2019, Cục Quản lý Dược đã có công văn số 16814/QLD-CL thông báo thu hồi một số thuốc chứa ranitidin nhiễm tạp chất, trong đó có biệt dược gốc Zantac
Căn cứ thông báo của Cơ quan Khoa học y tế Singapore (HSA), Cơ quan quản lý dược phẩm Thụy Sĩ (Swissmedic) về việc thu hồi các thuốc chứa Ranitidine do phát hiện chứa tạp chất N-nitrosodimethylamine (NDMA) có nguy cơ gây ung thư ở hàm lượng vượt quá ngưỡng cho phép của quốc tế. Đê đảm bảo an toàn cho người sử dụng, Cục Quản lý Dược yêu cầu:
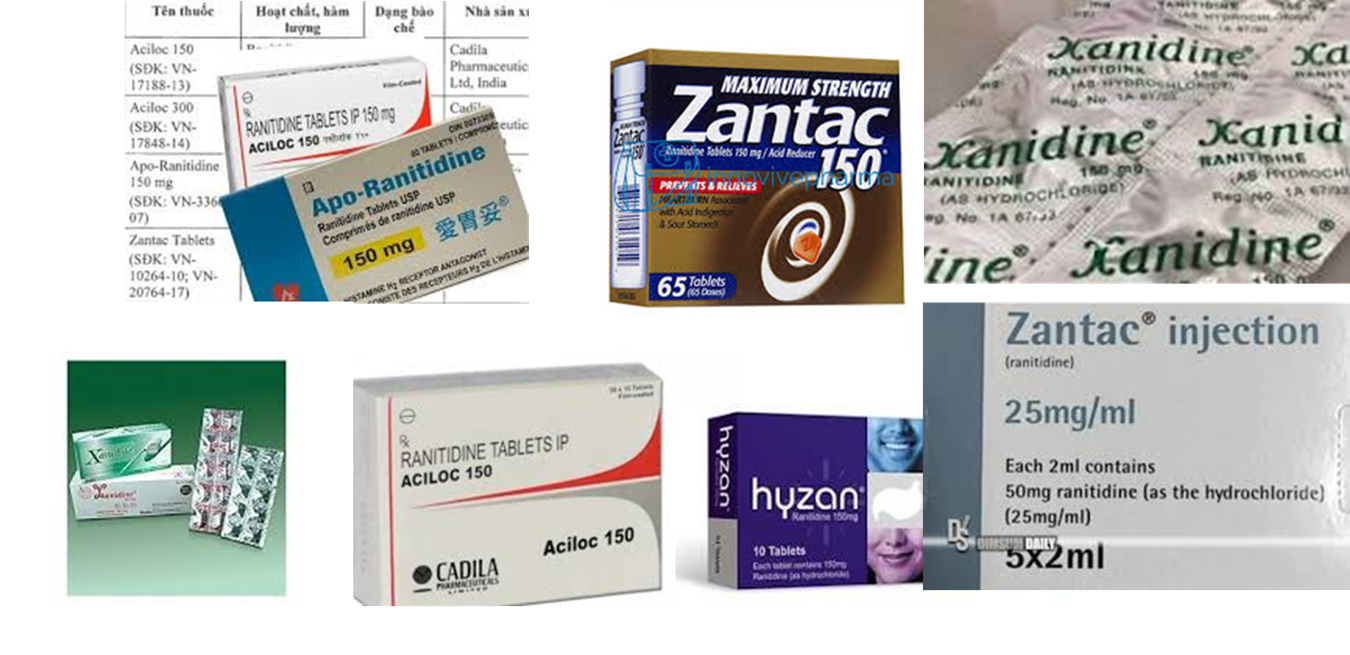
- Thu hồi tất cả các thuốc thành phấm có tên sau đây:
- Aciloc 150 (SĐK: VN17188-13) chứa Ranitidine (dưới dạng Ranitidine HC1) 150 mg Viên nén bao phim của Cadila Pharmaceuticals Ltd, India
- Aciloc 300 (SĐK: VN17848-14) chứa Ranitidine (dưới dạng Ranitidine HC1) 300 mg Viên nén bao phim của Cadila Pharmaceuticals Ltd, India
- Apo-Ranitidine 150 mg (SĐK: VN-3366- 07) chứa Ranitidine (dưới dạng Ranitidine HC1) 150 mg Viên nén của Apotex Inc., Canada
- Zantac Tablets (SĐK: VN10264-10; VN20764-17) chứa Ranitidine HC1 tương đương Ranitidine 150 mg Viên nén bao phim của Glaxo Wellcome S.A., Spain
- Zantac Injection (SĐK: VN10265-10; VN20516-17) chứa Ranitidine HC1 tương đương Ranitidine 25 mg/ml Dung dịch tiêm của GlaxoSmithKline Manuíacturing S.p.A., Italy
- Ratylno-150 (SĐK: VN18567-14) (Tên tại Singapore: Zynol150Tablet 150 mg) chứa Ranitidine 150 mg Viên nén bao phim của Micro Labs Ltd, India
- Hyzan Tablet 150 mg chứa Ranitidine 150 mg Viên nén bao phim Xepa-Soul Pattinson (Malaysia) Sdn Bhd, Malaysia
- Neoceptin R-150 Tablet 150 mg chứa Ranitidine 150 mg Viên nén bao phim của Beximco Pharmaceuticals Ltd
- Vesyca film coated tablet 150mg chứa Ranitidine 150 mg Viên nén bao phim Y.s.p. Industries (M) Sdn. Bhd,. Malaysia
- Xanidine Tablet 150 mg chứa Ranitidine 150 mg Viên nén bao phim của Berlin Pharmaceutical Industry Co Ltd, Thailand
- Zantac Syrup 150 mg/10 ml chứa Ranitidine 150 mg/ 10 rnl Si rô của Aspen Bad Oldesloe GmbH, Germany Glaxo Wellcome Operations
 Trước đó, Cục Quản lý Dược cũng đã có công văn số 16813/QLD-CL ( cùng ngày 02/10/2019) yêu cầu các cơ sở sản xuất thuốc chứa dược chất Ranitidine chỉ được đưa vào sản xuất thuốc các lô nguyên liệu dược chất Ranitidine không có tạp chất NDMA. Trường hợp lô nguyên liệu dược chất Ranitidine có tạp chất NDMA thì không được vượt quá giới hạn cho phép của tạp chất NDMA theo giới hạn chấp nhận quy định tại ICH M7.
Trước đó, Cục Quản lý Dược cũng đã có công văn số 16813/QLD-CL ( cùng ngày 02/10/2019) yêu cầu các cơ sở sản xuất thuốc chứa dược chất Ranitidine chỉ được đưa vào sản xuất thuốc các lô nguyên liệu dược chất Ranitidine không có tạp chất NDMA. Trường hợp lô nguyên liệu dược chất Ranitidine có tạp chất NDMA thì không được vượt quá giới hạn cho phép của tạp chất NDMA theo giới hạn chấp nhận quy định tại ICH M7.Cụ thể: Giới hạn NDMA tạm thời chấp nhận không quá 0.32 ppm (tính trên liều chấp nhận tối đa của NDMA là 96 nanogram/ngày và liều sử dụng tối đa của Ranitidine là 300mg/ngày).
Đồng thời, thực hiện đánh giá và kiểm soát chặt chẽ cơ sở cung ứng nguyên liệu, nguồn gốc nguyên liệu. Kiểm tra chất lượng từng lô nguyên liệu dược chất Ranitidine theo quy định và phân tích bổ sung chỉ tiêu đối với tạp chất NDMA.
Ngừng lưu hành thuốc trên toàn cầu
Sau khi Cơ quan Thực phẩm và Dược phẩm Mỹ (FDA) tìm thấy các tạp chất N-nitrosodimethylamine (NDMA) có nguy cơ gây ung thư ở hàm lượng vượt quá ngưỡng cho phép.
Nhà sản xuất thuốc Thụy Sĩ Novartis đã ngừng phân phối toàn cầu các loại thuốc Ranitidine vào tháng trước.
Tuần trước, các chuỗi nhà thuốc thuộc tập đoàn Walmart gồm CVS Health Corp, Walgreen Boots Alliance Inc và Rite Aid Corp đã ngừng bán các loại thuốc trị chứng ợ nóng không kê đơn có chứa ranitidine.
Cơ quan y tế của Canada đã yêu cầu các nhà sản xuất thuốc ngừng phân phối loại thuốc này trong lúc chờ đợi thu thập thêm thông tin. Tháng trước, các cơ quan quản lý ở Hồng Công (Trung Quốc) đã rút bốn sản phẩm có chứa Ranitidine. Còn tại Ireland, 13 sản phẩm có chứa Ranitidine đã bị thu hồi.
Ngày 8-10 Hãng dược phẩm GlaxoSmithKline (GSK) cho biết đang thu hồi sản phẩm Zantac, thuốc chống ợ nóng và các triệu chứng liên quan tới dạ dày phổ biến ở tất cả các thị trường trên toàn cầu.
N -Nitrosodimethylamine ( NDMA ) là một , được sản xuất dưới dạng sản phẩm phụ của một số quy trình công nghiệp và hiện diện ở mức rất thấp trong một số thực phẩm nhất định, đặc biệt là những thực hun khói .
NDMA tan trong nước, có màu vàng và ít hoặc không có mùi vị.
Nó độc hại cho gan và các cơ quan khác và là người. Nó cũng được sử dụng để tạo ung thư ở chuột để nghiên cứu ung thư.
Nguồn: Trung tâm DI & ADR Quốc gia
Khoa dược Trường Cao đẳng Y dược Hà nội – tổng hợp

 Trước đó, Cục Quản lý Dược cũng đã có công văn số 16813/QLD-CL ( cùng ngày 02/10/2019) yêu cầu các cơ sở sản xuất thuốc chứa dược chất Ranitidine chỉ được đưa vào sản xuất thuốc các lô nguyên liệu dược chất Ranitidine không có tạp chất NDMA. Trường hợp lô nguyên liệu dược chất Ranitidine có tạp chất NDMA thì không được vượt quá giới hạn cho phép của tạp chất NDMA theo giới hạn chấp nhận quy định tại ICH M7.
Trước đó, Cục Quản lý Dược cũng đã có công văn số 16813/QLD-CL ( cùng ngày 02/10/2019) yêu cầu các cơ sở sản xuất thuốc chứa dược chất Ranitidine chỉ được đưa vào sản xuất thuốc các lô nguyên liệu dược chất Ranitidine không có tạp chất NDMA. Trường hợp lô nguyên liệu dược chất Ranitidine có tạp chất NDMA thì không được vượt quá giới hạn cho phép của tạp chất NDMA theo giới hạn chấp nhận quy định tại ICH M7.